
 |
Lexikon "Fachbegriffe" |
Katalysatoren sind Stoffe, die die Geschwindigkeit einer chemischen Reaktion durch Herabsetzung der Aktivierungsenergie erhöhen. Die Katalysatoren werden dabei nicht verbraucht. Der von den Katalysatoren ausgelöste Vorgang wird als Katalyse bezeichnet. Der Name "Katalysator" ist abgeleitet von dem griechischen Wort »catalysis« (= Auflösung, Hindernis beseitigen).
Katalysatoren werden in der Industrie häufig eingesetzt. Viele Lebensvorgänge sind an das Vorhandensein von Biokatalysatoren (Enzyme) geknüpft.
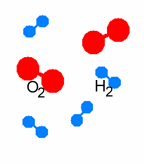
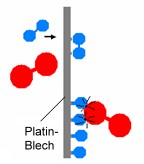
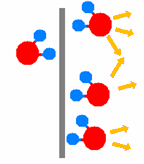
| Wirkungsweise von Katalysatoren am Beispiel der Knallgas-Reaktion 2 H2 + O2 |
||||
 |
 |
 |
||
| Ausgangszustand | Platin-Blech als Katalysator | Desorption | ||
|
|
|
||
| Energiediagramm | ||||
|
||||
 |
 |
| Es gelingt nicht, mit einem Streichholz - auch nicht mit einem Gasbrenner - einen Zuckerwürfel in Brand zu setzen. | Gibt man auf den Zuckerwürfel aber etwas Zigarettenasche, so lässt er sich entzünden und brennt mit kleiner, unscheinbarer Flamme. Eisenverbindungen, die in geringer Menge in der Asche vorhanden sind, wirken hierbei als Katalysator. |
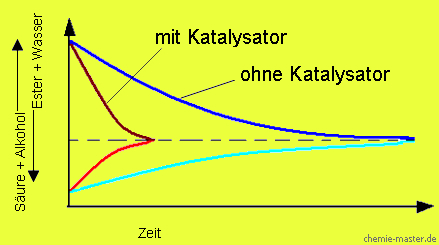
Wirkung eines Katalysators auf das chemische Gleichgewicht
Ein Katalysator beeinflusst nicht die Lage eines chemischen Gleichgewichts. Er bewirkt aber eine Beschleunigung der Gleichgewichtseinstellung, da er die Reaktionsgeschwindigkeit beschleunigt.
Autokatalyse
Unter Autokatalyse versteht einen katalytischen Vorgang, bei dem ein gebildetes Reaktionsprodukt als Katalysator für den Fortgang der Reaktion wirkt. Als Beispiel hierfür ist die Hydrolyse der Ester zu nennen: Die Reaktionsgeschwindigkeit wird durch die gebildeten Wasserstoff-Ionen beschleunigt.
Die Autokatalyse darf nicht verwechselt werden mit dem Abgaskatalysator im Auto, der gemeinhin als "Autokatalysator" bezeichnet wird!
Textelemente und Grafiken von Miriam Brandstetter.