
 |
Lexikon "Experimentieren" |
Natriumhydroxid (NaOH) ist ein Salz. Die Na+- und OH--Ionen sind in einem Kristallgitter angeordnet. Beim Lösen in Wasser kann man zwei Vorgänge beobachten:
Um herauszufinden ob sich das System erwärmt oder abkühlt, muss man die beiden Energien vergleichen. Wird Energie verbraucht, so kühlt sich das System ab. Umgekehrt wird Energie freigesetzt, so erwärmt sich ein System. Wenn nun die Hydratationsenergie (freiwerdend) größer ist als die (aufzuwendende) Gitterenergie, erwärmt sich ein System. Im umgekehrten Fall kühlt sich das System ab.
Ist die Differenz zwischen Gitter- und Hydratationsenergie zu hoch, so muss ein System erhitzt werden, da es die nötige Energie nicht allein aus dem eigenen System aufbringen kann (Beispiel: schwerlösliche Salze).
Waage, Becherglas (100 ml), Löffelspatel, Messzylinder (100 ml), Glasstab, Thermometer
Natriumhydroxid Plätzchen (7,2 g), entmineralisiertes Wasser (50 ml), Indikatorpapier + pH-Wert Skala
Mit Hilfe einer Waage wiegt man so genau wie möglich 7,2 g Natriumhydroxid Plätzchen ab. Dann misst man mit einem Messzylinder so genau wie möglich 50 ml entmineralisiertes Wasser ab und gibt dieses in das Becherglas. Nun misst man die Anfangstemperatur des Wassers, dann gibt man die Natriumhydroxid Plätzchen hinzu und rührt mit dem Glasstab um. Dabei wird alle 10 Sekunden die Temperatur notiert. Nach 5 Minuten wird der Versuch beendet und nur noch der pH-Wert der entstandenen Lösung bestimmt.
Anfangstemperatur des Wassers: 22 °C
| Temperatur des Gemisches | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
pH-Wert nach 5 Minuten: 10
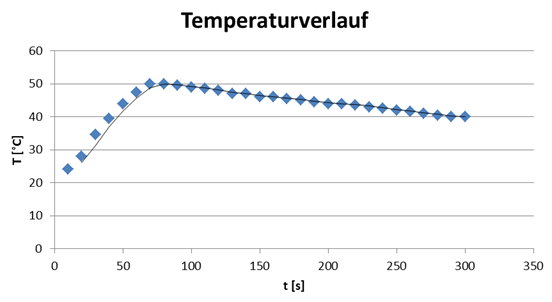
Das System hat sich erwärmt. Die freiwerdende Energie (Hydratationsenergie) ist also größer als die aufzuwendende Gitterenergie. Diese Reaktion, wo Energie in Form von Wärme freigesetzt wird, nennt man auch eine exotherme Reaktion. Der umgekehrte Fall wäre eine endotherme Reaktion.
Das entstandene Produkt, Natriumhydroxid in wässriger Lösung, nennt man auch Natronlauge.
NaOH(s) + H2O(l) ![]() Na+(aq) + OH-(aq) + H2O(l)
Na+(aq) + OH-(aq) + H2O(l)
Die pH-Wert Messung am Ende des Versuches bestätigt, dass OH--Ionen entstanden und in der Lösung vorhanden sind.
| Natriumhydroxid ist hygroskopisch (wasserziehend), das heißt es entzieht sogar der Luft Wasserdampf. Daher kann man sich die heftige Reaktion mit Wasser erklären. |
| Die Anfangskonzentration von Natriumhydroxid ist sehr groß, das bedeutet es finden viele Reaktionen in kurzer Zeit statt. Die Konzentration nimmt jedoch mit der Zeit ab und daher können nicht mehr so viele Reaktionen stattfinden. |
| Größere Mengen sollte man an einem trockenen Ort mit niedriger Luftfeuchtigkeit aufbewahren und nicht mit Wasser oder wässrigen Lösungen in Verbindung bringen. |
| Lässt man Natronlauge an der Luft stehen, so entsteht allmählich Natriumcarbonat und Wasser, wobei das Wasser als Wasserdampf in die Luft entweicht und somit nur Natriumcarbonat zurückbleibt. |
| 2 Na+(aq) + 2 OH-(aq) + CO2(g) |
Kathrin Brcic Kostic