| chemie-master.de: CD-ROM-Fassung bestellen |
Das Periodensystem der Elemente für den Schulgebrauch |
zurück |
| Americium | |
7. Periode _______________ |
|
|
|
|
| Elementart: Metall | Oxidationsstufe(n): +3 (+4, +5, +6) |
| Schmelztemperatur: 1176 °C (1449 K) | Elektronegativität: 1,3 |
| Siedetemperatur: 2607 °C (2880 K) | Atomradius: 173 pm |
| Dichte: 13,671 g/cm3 | Erdkrustenhäufigkeit: künstlich |
| Anordnung der Elektronen | |||||||||||||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | .. | 6s | 6p | 6d | ... | 7s |
| 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 7 | 2 | 6 | 2 | |||
| Name | Das in der gleichen Gruppe über dem Americium stehende Europium wurde nach dem Kontinent, auf dem es entdeckt wurde, benannt. In Entsprechung dazu erhielt das neu gefundene Element den Namen Americium. | ||||
| Entdeckung | Ende 1944/Anfang 1945 isolierten Seaborg, James, Morgan und Ghiorso am metallurgischen Laboratorium der Universität von Chicago aus einer Plutonium-Probe, die im Reaktor mit Neutronen bestrahlt wurde, ein bis dahin noch unbekanntes, a-Strahlen aussendendes langlebiges Nuklid. Das Nuklid entstand durch mehrfachen Neutroneneinfang aus 239Pu: 239Pu + n 240Pu + n 241Pu Die erste wägbare Menge an Americium (241Am) - einige wenige Mikrogramm - wurde von Cunningham 1945 isoliert. Heutzutage wird 241Am in Kilogramm-Mengen produziert. |
||||
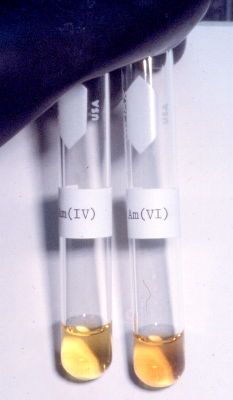
| Eigenschaften | Americium ist ein geschmeidiges Metall. Es scheint leichter verformbar zu sein als Uran oder Neptunium. Im Vergleich zu Plutonium und Neptunium hat frisch bereitetes Americium einen stärkeren silbrig-weißen Glanz, der in trockener Luft bei Zimmertemperatur allmählich ermattet. Das Metall kann in sehr reiner Form durch Erhitzen auf Dank an Dr. A. Kronenberg, www.kernchemie.de  Americium in Brocken. Americium löst sich leicht in verdünnten Mineralsäuren. In wässriger Lösung ebenso wie in festen Verbindungen liegt Americium in den Oxidationsstufen +3 (blassrot), +4 (blassrot), +5 (gold-braun) und +6 (goldbraun) vor. Am stabilsten ist Am3+. Das Verhalten von Am3+ entspricht der Stellung des Americiums als Element der Actinoiden-Reihe im Periodensystem und der Analogie zu den Lanthanoiden. Im Gegensatz zu seinem Homologen Europium kann Am3+ nicht zu Am2+ reduziert werden. Es gibt jedoch Hinweise auf eine Existenz von Am(II). Verbindungen des Americiums in den höheren Oxidationsstufen (+4 bis +6) stellen starke Oxidationsmittel dar. Sie sind nur stabil bei Abwesenheit oxidierbarer Substanzen. Ihr Oxidationsvermögen ist vergleichbar dem des Permanganat-Ions (MnO4–) in saurer Lösung.
|
||||
| Verwendung | Der größte Anteil des produzierten 241Am dient zur Gewinnung von 242Cm als Vorstufe von 238Pu. 241Am findet auch Verwendung in Neutronenquellen oder in Ionisationsrauchmeldern.
|
||||
| Isotope |  Nur Radionuklide, keine stabilen Isotope. Nur Radionuklide, keine stabilen Isotope.241Am ist ein a-Strahler mit ungefähr der dreifachen Aktivität des Radiums. Seine Halbwertszeit beträgt 432,2 Jahre. Langlebigstes Isotop ist 243Am mit einer Halbwertszeit von 7370 Jahren. |
||||
| Redox-Potenziale |
|
 |
© chemie-master.de - Website für den Chemieunterricht | Seitenübersicht| Lizenz & Urheberrecht| Arbeitsblätter | | Danksagungen | Kritik | |
 |