| chemie-master.de: CD-ROM-Fassung bestellen |
Das Periodensystem der Elemente für den Schulgebrauch |
zurück |
| Quecksilber | |
(Zinkgruppe) 6. Periode ________________ 12. Gruppe (IUPAC 89) |
|
|
|
|
| Elementart: Metall | Oxidationsstufe(n): +2 (+1) |
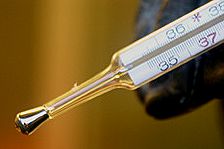
| Schmelztemperatur: -38,83 °C (234,32 K) | Elektronegativität: 1,9 |
| Siedetemperatur: 356,73 °C (629,88 K) | Atomradius: 150 pm |
| Dichte: 13,55 g/cm3 | Erdkrustenhäufigkeit: 4×10–5 % |
| Anordnung der Elektronen | |||||||||||||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | .. | 6s | 6p | 6d | ... | 7s |
| 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 2 | ||||||
| Name | »Flüssiges (lebendiges) Silber«, Symbol von griech. »hydrargyrum«. | ||||||
| Entdeckung |
|
||||||
| Vorkommen | Gediegen (Tröpfchen im Gestein) oder als Cinnabarit (Zinnober, HgS). Cinnabarit aus Almadén, Spanien. Betrachtet man den Cinnabarit mit der Lupe, so lassen sich kleine Tröpfchen von gediegenem Quecksilber erkennen. |
||||||
| Eigenschaften |
 Transportgefäße für Quecksilber aus Gusseisen bzw. Stahl, aus mehreren Jahrhunderten stammend, zu sehen im Stadtmuseum von Idria (Slowenien). Quecksilberoxid HgO zerfällt oberhalb 400 °C leicht in die Elemente. Quecksilber in Quecksilberwanne
Quecksilber gibt bereits bei Zimmertemperatur Dämpfe ab, die zu Vergiftungen führen können.
Lösliche Verbindungen sind sehr giftig! Verschüttetes Quecksilber sofort restlos unschädlich machen, z.B. durch Aufnehmen mit der Quecksilberzange, Bestreuen mit Zinkpulver, Iodkohle oder Quecksilberabsorbens! |
||||||
| Herstellung | Durch Abrösten von Cinnabarit: |
||||||
| Verwendung |
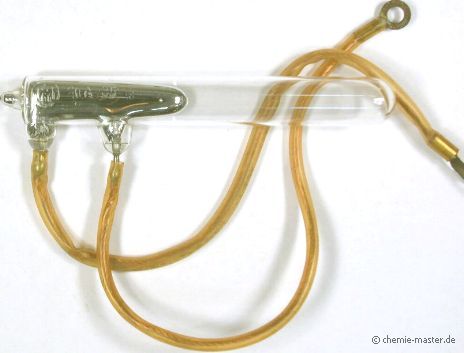 Quecksilber-Schaltkontakt für starke Ströme
|
||||||
| Isotope | 196Hg (0,15%), 198Hg (9,97%), 199Hg (16,87%), 200Hg (23,10%), |
||||||
| Redox-Potenziale |
|
 |
© chemie-master.de - Website für den Chemieunterricht | Seitenübersicht| Lizenz & Urheberrecht| Arbeitsblätter | | Danksagungen | Kritik | Links | |
 |