
 |
Lexikon "Fachbegriffe" |
Aus dem gemahlenen Bauxit wird Aluminiumoxid mit Hilfe von Natronlauge herausgelöst.
Der ungelöste Rotschlamm wird abfiltriert und aus der Lösung wird Aluminiumhydroxid
Das Aluminiumhydroxid wird geglüht. Dabei bildet sich Aluminiumoxid
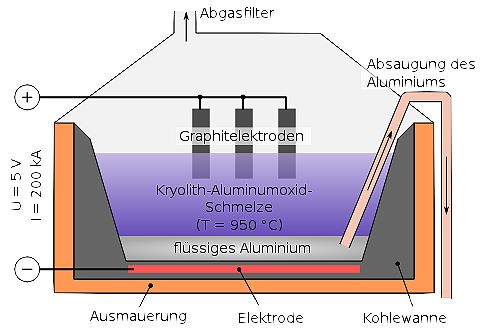
Aluminiumoxid Al2O3 wird zur Erniedrigung der Schmelztemperatur mit Kryolith versetzt und einer Schmelzflusselektrolyse unterzogen. Dabei entsteht an der Kathode (Minuspol) Aluminium und an der Anode (Pluspol) Sauerstoff. Der entstehende Sauerstoff oxidiert die Kohle-Elektroden zu Kohlenstoffdioxid CO2.
Al2O3 ![]() 2 Al + 3 O
2 Al + 3 O
2 Al3+ + 6 e- ![]() 2 Al
2 Al
3 O2- ![]() 3 O + 6 e-
3 O + 6 e-
Die Produktion von Aluminium ist sehr energieaufwändig. Um eine Tonne Aluminium-Metall zu produzieren, werden 1,9 t Aluminiumoxid (4 t Bauxit), 0,5 t Anodenkohle und 50 kg Kryolith benötigt. Der Stromverbrauch beträgt 15.000 kWh. Das Verfahren wurde 1892 von dem Österreicher K. J. Bayer entwickelt.
Siehe: Arbeitsblatt "Vom Bauxit zum Aluminium"
Foto Bauxit