
 |
Lexikon "Fachbegriffe" |
Die Elektronenhülle der Atome weist ein bestimmte Struktur auf. Der Aufenthaltsraum der Elektronen in der Hülle ist nicht beliebig. Die Elektronen können nur ganz bestimmte Energiezustände (Energieniveaus) annehmen. Die unterschiedlichen Energieniveaus werden auch als Schalen bezeichnet. Der dänische Physiker Niels Bohr erkannte als erster diesen Schalenaufbau der Atomhülle. Man spricht deshalb vom Bohr'schen Atommodell.
 |
Schalenaufbau der Atomhülle |
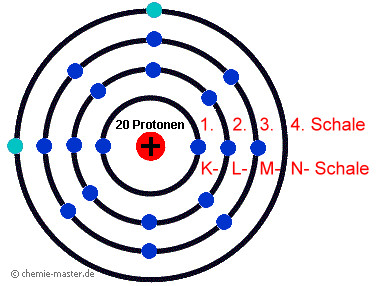
Schalenmodell des Calcium-Atoms. Die 1. Schale (innerste Schale, K-Schale) ist mit zwei Elektronen voll besetzt. Die 2. Schale hat mit acht Elektronen die auf dieser Schale maximal mögliche Elektronenzahl erreicht. Die 3. Schale ist nur mit acht Elektronen besetzt. Obwohl auf der 3. Schale 18 Elektronen, also noch zehn weitere Elektronen, Platz finden könnten, beginnt nach acht Elektronen, einem Oktett, der Aufbau der nächstfolgenden Schale. Die 4. Schale – beim Calcium-Atom ist das die Außenschale – umfasst zwei Elektronen, die Außenelektronen. Von der Zahl der Außenelektronen (Valenzelektronen) wird das chemische Verhalten eines Elements maßgeblich bestimmt.
|
Die maximale Anzahl von Elektronen auf einer Schale lässt sich nach folgender Formel ermitteln:
2 n2n steht dabei für die Nummer der Schale bzw. des Energieniveaus. |
Hinweis:
Darstellungen des Schalenaufbaus sowie der entsprechenden Energieniveauschemata der ersten 20 Elemente finden sich auch im ![]() »Periodensystem für den Schulgebrauch«.
»Periodensystem für den Schulgebrauch«.
Niels Bohr
Außenelektronen
Arbeitsblatt "Atombau und Periodensystem"