
 |
Lexikon "Fachbegriffe" |
Die Energie, die zur Abtrennung eines Elektrons von einem isolierten Atom (X) notwendig ist, wird als erste Ionisierungsenergie bezeichnet.
X ![]() X+ + e–
X+ + e–
Unter der zweiten Ionisierungsenergie versteht man die zur Abtrennung des zweiten Elektrons von einem Ion (X+) erforderliche Energie.
X+ ![]() X2+ + e–
X2+ + e–
Für die dritte und folgende Ionisierungsenergien gilt das Entsprechende.
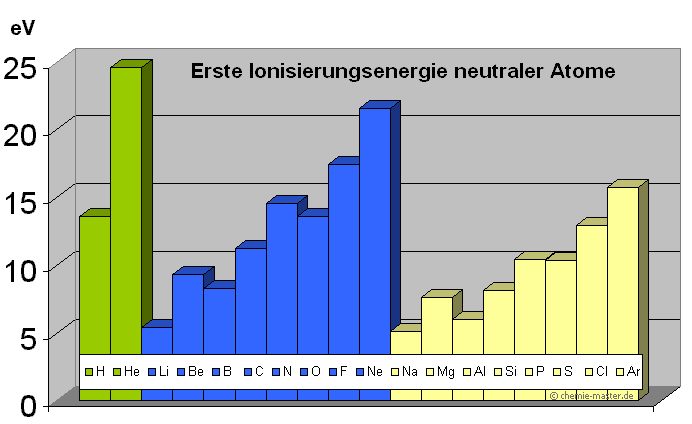
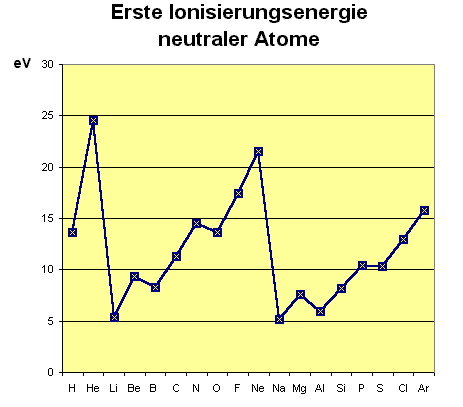 |
Element | energie (eV) |
| 1. Periode | ||
| Wasserstoff | 13,598 | |
| Helium | 24,588 | |
| 2. Periode | ||
| Lithium | 5,392 | |
| Beryllium | 9,322 | |
| Bor | 8,298 | |
| Kohlenstoff | 11,260 | |
| Stickstoff | 14,534 | |
| Sauerstoff | 13,618 | |
| Fluor | 17,422 | |
| Neon | 21,564 | |
| 3. Periode | ||
| Natrium | 5,139 | |
| Magnesium | 7,646 | |
| Aluminium | 5,986 | |
| Silicium | 8,151 | |
| Phosphor | 10,468 | |
| Schwefel | 10,360 | |
| Chlor | 12,967 | |
| Argon | 15,759 | |
1 Elektronvolt (eV) entspricht 96,4853 kJ/mol.
1 eV ist die Energie, die ein Elektron aufnimmt, wenn es beim freien Durchlaufen einer
Spannung von 1 V beschleunigt wird.
Siehe auch:
Tabelle: Ionisierungsenergien