
 |
Lexikon "Fachbegriffe" |
In Kupfersulfat-Lösung (enthält Cu2+ -Ionen) gibt man einen Eisennagel (enthält Fe-Atome). Nach einiger Zeit ist der Nagel verkupfert.
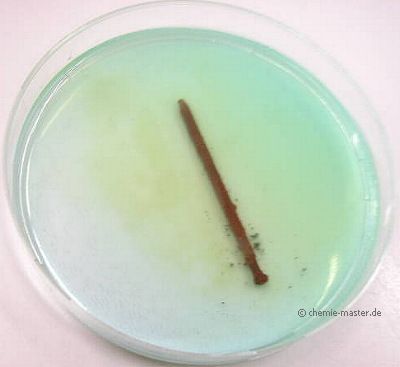
Es muss folgende Redoxreaktion abgelaufen sein:
Cu2+ + Fe ![]() Cu + Fe2+
Cu + Fe2+
Eisenatome haben also Außenelektronen an die Kupfer-Ionen abgegeben und sind dabei selbst zu Ionen geworden.
In Eisensulfat-Lösung (enthält Fe2+ -Ionen) taucht ein Kupferblech (enthält Cu-Atome). Es ist keine Reaktion zu beobachten.
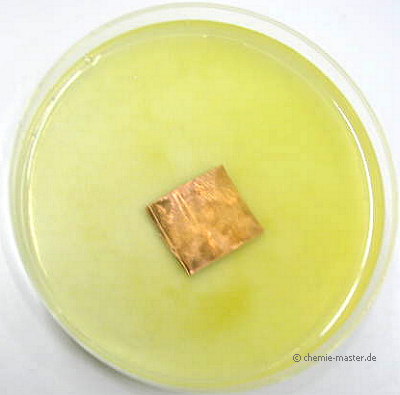
Eisen hat gegenüber Kupfer das größere Oxidationsbestreben.
Ordnet man die Metalle nach der Größe ihres Oxidationsbestrebens, so erhält man die Redoxreihe der Metalle.
Siehe:
Redoxreihe der Metalle
Kupfersulfat