
 |
Lexikon "Fachbegriffe" |
Wasser ist einer der wenigen Stoffe, die sich beim Erstarren ausdehnen. Warum ist Wasser bei gewöhnlicher Temperatur flüssig, Kohlenstoffdioxid aber gasförmig? Um dieses eigenartige Verhalten zu erklären, muss man sich den Bau der Wasser-Moleküle ansehen.
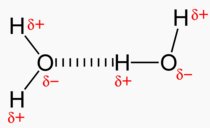
Das Wasser-Molekül ist gewinkelt gebaut. Die beiden Wasserstoff-Atome stehen in einem Winkel von 105° zueinander. Sauerstoff zieht auf Grund seiner größeren Elektronegativität Bindungselektronen stärker an als Wasserstoff. Dies führt dazu, dass Sauerstoff im Wasser-Molekül gegenüber dem Wasserstoff eine negative Teilladung erhält. Im Wasser-Molekül fallen die Schwerpunkte von negativer und positiver Teilladung auseinander. Das Wasser-Molekül ist ein Dipolmolekül.

Grafik: Miriam Brandstetter 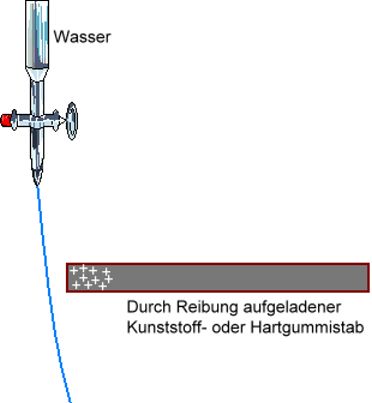 |
Ein durch Reibung elektro- statisch aufgeladener Kunststoff- oder Hart- gummi-Stab zieht die Wasser-Moleküle an. Der z.B. positiv aufgeladene Stab zieht die negativen Enden der Wasser-Moleküle an. Steht dem Stab ein positiv geldenes Ende eines Wasserdipols gegenüber, so wird es zunächst abge- stoßen, wegen der freien Beweglichkeit der Teilchen in einer Flüssigkeit dreht es sich aber um und wird dann ebenfalls angezogen. Vergleiche: Tetrachlormethan |
Auf Grund des Dipolcharakters der Wasser-Moleküle ziehen sich die Moleküle gegenseitig stark an. Sie bilden "Klumpen" von Wasser-Molekülen (Haufen, Cluster, Wasserassoziate). Damit Wasser gasförmig werden kann, müssen die "Wasserstoffbrücken" zwischen den Molekülen aufgetrennt werden. Dies erfordert Energiezufuhr. Deshalb hat Wasser mit 100 °C eine für seine Molekülgröße (Molekülmasse 18 u) sehr hohe Siedetemperatur. Zum Vergleich: Das Kohlenstoffdioxid-Molekül ist mit einer Molekülmasse von 44 u mehr als doppelt so schwer als das Wasser-Molekül. Kohlenstoffdioxid ist aber bereits ab -78,5 °C gasförmig. Kohlenstoffdioxid-Moleküle sind nicht gewinkelt gebaut, die Ladungsschwerpunkte der Teilladungen fallen dadurch zusammen. Das Molekül hat keinen Dipolcharakter. Hätte das Wasser-Molekül keinen Dipolcharakter, so läge seine Schmelztemperatur bei ca.
Wasser hat bei 4 °C seine größte Dichte. Erstarrt Wasser, so dehnt es sich aus. Eis hat eine geringere Dichte als flüssiges Wasser. Dadurch schwimmt Eis auf flüssigem Wasser, gefrieren Gewässer nur an der Oberfläche zu, nicht aber vom Grund her, so dass Wasserorganismen Überlebenschancen auch bei tiefen Temperaturen haben.

Nur wenige andere Flüssigkeiten dehnen sich beim Abkühlen aus und verringern dabei ihre Dichte. Die Ausdehnung des Wassers beim Erstarren führt dazu, dass Wasserleitungen bei Frost platzen und dass mit Wasser gefüllte Spalten in Gesteinen zu dessen Sprengung führen. Entsprechendes geschieht bei Frostaufbrüchen an Straßen: Wasser unter dem Teerbelag gefriert und das entstehende Eis nimmt ein größeres Volumen ein, so dass der Belag vom Untergrund weggedrückt wird.
Wegen seines "unnormalen" Verhaltens spricht man von der "Anomalie des Wassers". Alle Wasserstoffverbindungen der Nichtmetalle – mit Ausnahme des Wassers (Wasserstoffverbindung des Sauerstoffs) – sind bei gewöhnlicher Temperatur gasförmig.

Siehe:
Wassermolekül (3D)
Wasserstoffbrücken (3D)
Gitterstruktur des Eises (3D)