| chemie-master.de: CD-ROM-Fassung bestellen |
Das Periodensystem der Elemente für den Schulgebrauch |
zurück |
| Radium | |
(Erdalkalimetalle) 7. Periode _______________ 2. Gruppe (IUPAC 89) |
|
|
|
|
| Elementart: Metall | Oxidationsstufe(n): +2 |
| Schmelztemperatur: 700 °C (973 K) | Elektronegativität: 0,9 |
| Siedetemperatur: 1737 °C (2010 K) | Atomradius: 223 pm |
| Dichte: 5 g/cm3 | Erdkrustenhäufigkeit: 10–10 % |
| Anordnung der Elektronen | |||||||||||||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | .. | 6s | 6p | 6d | ... | 7s |
| 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 2 | 6 | 2 | ||||
| Lewis-Schreibweise | |||||||||||||||||||
| Das Radium-Atom gibt die beiden Außenelektronen ab und bildet ein Ra |
|||||||||||||||||||
| Name | Von »radius«, lat. der Strahl. | ||||
| Entdeckung | Schon bald nach der Entdeckung der Strahlung des Urans durch Becquerel (1896) bemerkten Marie und Pierre Curie, dass die von dem Uranmineral Pechblende ausgehende Radioaktivität stärker ist, als nach der darin enthaltenen Uranmenge zu erwarten gewesen wäre. Sie vermuteten, dass in der Pechblende ein noch unbekanntes, hochradioaktives Element in kleinsten Mengen enthalten sein müsse. Um diese Frage zu klären, begannen sie auf eigene Kosten mit der äußerst schwierigen Aufarbeitung von 1000 kg Pechblenderückständen, die ihnen die Bergwerksverwaltung von St. Joachimsthal in Böhmen (damals Österreich-Ungarn, heute Jáchymov, Tschechische Republik) geschenkt hatte. Tatsächlich erhielten sie zwei Fraktionen, in denen sich die erhöhte Radioaktivität konzentrierte: Eine Fraktion mit Bismutsalzen und eine mit Bariumsalzen. Es mussten also mindestens zwei stark radioaktive Elemente in der Pechblende enthalten sein. Zunächst untersuchten sie die Bismutfraktion und fanden darin ein noch unbekanntes Element, für das sie den Namen Polonium vorschlugen. Nach der Entdeckung des Poloniums erfolgte die Untersuchung der Bariumfraktion. Am 26. Dezember 1898 teilten die Curies mit, dass mehrere Gründe sie veranlassten, "mit Überzeugung auszusprechen, dass dieser radioaktive Stoff ein neues Element enthält, dem wir den Namen Radium zu geben wünschen." 1902 erhielten sie in mühsamer Arbeit  Pierre und Marie Curie an ihrem Arbeitsplatz in der angemieteten Fabrikhalle in Paris, in der sie 1898 das Polonium und das Radium entdeckten. |
||||
| Eigenschaften | Weiß glänzendes Schwermetall. Wird an der Luft durch Bildung von Radiumnitrid Ra3N2 rasch schwarz. Reagiert ähnlich wie Kalium mit Wasser (Ra + 2 H2O Foto: Deutsches Museum München
 2,5 Gramm Radiumbromid in einem Wägeröhrchen. Auf Grund der starken Radioaktivität leuchten Radiumverbindungen im Dunkeln. Die fotografische Aufnahme erfolgte mit Hilfe des von dem Präparat selbst ausgesandten Lichts. |
||||
| Vorkommen | Radium ist ein Zerfallsprodukt des Urans. Daher findet es sich in allen Uranerzen. Das Mengenverhältnis zwischen Radium und Uran beträgt ungefähr |
||||
| Verwendung | Als Lieferant von a-Strahlen kann Radium im Gemisch mit Beryllium für Neutronenquellen eingesetzt werden. 226Ra-Strahlenquelle: Im Deckel des Bleibehälters (rechts) sind
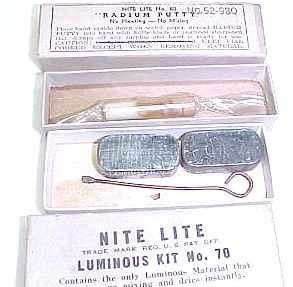
226Ra wurden früher häufig in Leuchtfarben für z.B. Leuchtziffern in Uhren oder Kompassen eingesetzt. Diese Leuchtfarben funktionierten auch in völliger Dunkelheit: Die von dem Radium ausgehende Strahlung trifft auf Zinksulfid, das mit Spuren von Kupfer oder Silber aktiviert wurde. Dabei wird Licht ausgesendet. Die Himmelsrichtungen dieses Kompasses der deutschen Wehrmacht aus der Zeit des
Weitere Informationen: |
||||
| Isotope |
|
||||
| Redox-Potenziale |
|
||||
 |
© chemie-master.de - Website für den Chemieunterricht | Seitenübersicht| Lizenz & Urheberrecht| Arbeitsblätter | | Danksagungen | Kritik | Links | |
 |
| Quellenangabe für diese Seite: http://www.chemie-master.de/pse/pse.php?modul=Ra [Stand 20.01.2026] |
||
 |
||