
 |
Lexikon "Fachbegriffe" |
Eine Elektrolyse ist eine unter Ionenentladung ablaufende Zerlegung einer chemischen Verbindung durch den elektrischen Strom. Es werden Redoxreaktionen durch Zufuhr von elektrischer Energie erzwungen. Zwei Teilvorgänge sind zu unterscheiden: Die Reaktion an der Kathode und die Reaktion an der Anode.
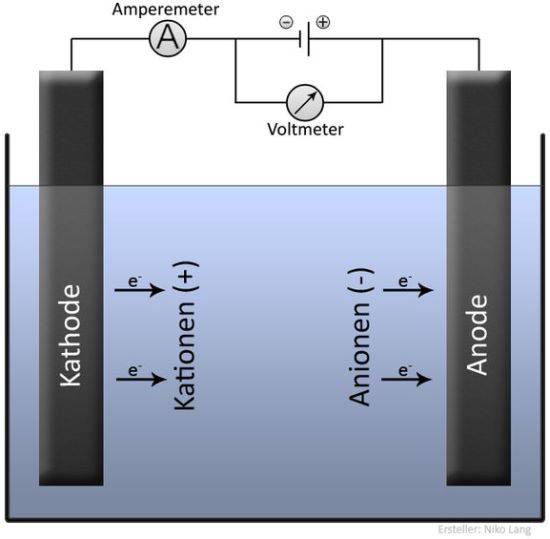
Am Minuspol herrscht Elektronenüberschuss. Die sich im Elektrolyten befindenden positiv geladenen Ionen (= Kationen) werden vom Minuspol angezogen und wandern dorthin. Dort werden sie durch Aufnahme von Elektronen (= Reduktion) entladen.
Beispiel: Cu2+ + 2 e– ![]() Cu
Cu
Am Pluspol herrscht Elektronenmangel. Zum Pluspol wandern die negativ geladenen Ionen (= Anionen). Dort werden sie durch Abgabe von Elektronen (= Oxidation) entladen.
Beispiel: 2 Cl– ![]() 2 Cl + 2 e–
2 Cl + 2 e–
Bei der Elektrolyse laufen die elektrochemischen Vorgänge gegenüber der galvanischen Zelle in entgegengesetzter Richtung ab.
Wichtige industrielle Anwendungsgebiete der Elektrolyse sind die Herstellung von Aluminium, die Alkalichlorid-Elektrolyse zur Gewinnung von Natronlauge und Chlor aus Steinsalz sowie die Galvanotechnik einschließlich des Eloxal-Verfahrens zur Oberflächenveredlung von Metallen.
Siehe:
Arbeitsblatt "Elektrolyse von Kupferchlorid"
Leitfähigkeit von Salzlösungen
Vom Bauxit zum Aluminium
Arbeitsblatt "Vom Bauxit zum Aluminium"
Alkalichlorid-Elektrolyse
Eloxal-Verfahren