
chemie-master.de
Website für den Chemieunterricht
 |
chemie-master.de |
Website für den Chemieunterricht |
Metall
Erdalkalimetall
II. Hauptgruppe
[Xe]6s2

|
|
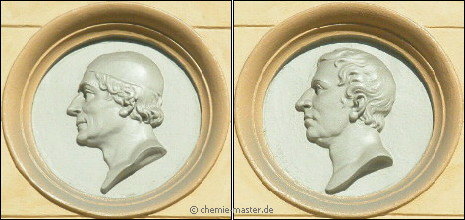
(Haus des Metallkontors in Stockholm) Johan Gottlieb Gahn (1745 - 1818, li.) und Carl Wilhelm Scheele (1742 - 1786, re.). |

|
|
(Nach einem Gemälde von L. Pasch, Schloss Gripsholm) Johan Gottlieb Gahn (1745-1818), Chemiker, Assessor am Bergskollegium in Stockholm |

|
|
Die frische Schnittfläche des Bariums verliert an der Luft durch Oxidation sofort ihren metallischen Glanz. |
| Ba ⇌ Ba2+ + 2 e– | +2,91 | Volt |