
chemie-master.de
Website für den Chemieunterricht
 |
chemie-master.de |
Website für den Chemieunterricht |

|
|
Schwefel-Kristalle. |

|
|
Der Schwefel in diesem Schwefelbrocken ist aus S8-Molekülen aufgebaut. |
|
|
|
Foto: Hanna Thum Schwefelabscheidung am Rand einer Fumarole, einer Erdspalte in vulkanischen Gebieten, aus der Wasserdampf und schwefelhaltige Gase austreten. |

|
|
Foto: Jan Dago Der Vulkan Kawah Ijen auf der Insel Java (Indonesien) lässt 200 °C heißen flüssigen Schwefel aus seinem Inneren hervorsprudeln. |
|
|
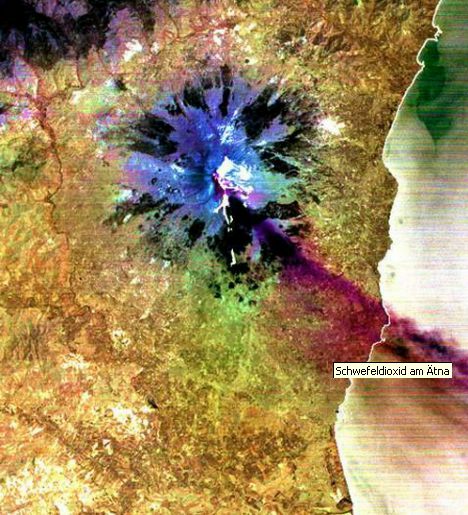
Courtesy: NASA Visible Earth Die aus dem Schlot des Vulkans Ätna auf Sizilien herausgeschleuderten Gase enthalten Schwefeldioxid. Das durch Computerauswertung von Satellitenaufnahmen entstandene Falschfarbenbild zeigt das an sich farblose Schwefeldioxid in rotbrauner Farbe. |

|
|
Durch Entschwefelung von Erdgas gewonnener Schwefel auf einer Halde (Lacq/Frankreich). |
| SO32– + 2 OH– ⇌ SO42– + H2O + 2 e– | –0,90 | Volt |
| S2– ⇌ S(s) + 2 e– | –0,51 | Volt |
| HS– + OH– ⇌ S(s) + H2O + 2 e– | –0,48 | Volt |
| 2 S2O3– ⇌ S4O62– + 2 e– | +0,17 | Volt |
| H2S(g) + 2 H2O ⇌ S(s) + 2 H3O+ + 2 e– | +0,17 | Volt |
| H2SO3 + 5 H2O ⇌ SO42– + 4 H3O+ + 2 e– | +0,17 | Volt |
| S(s) + 7 H2O ⇌ H2SO3 + 4 H3O+ + 4 e– | +0,45 | Volt |
| 2 SO42– ⇌ S2O82– + 2 e– | +2,01 | Volt |