
chemie-master.de
Website für den Chemieunterricht
 |
chemie-master.de |
Website für den Chemieunterricht |
Metall
Übergangsmetall
II. Nebengruppe
[Xe]4f145d106s2
|
Die Entdeckung des Quecksilbervorkommens von Idrija (Slowenien) soll durch einen namentlich nicht bekannten Fassmacher erfolgt sein, der seine Holzgefäße in einem Brunnen an der Südseite des Idrija-Tals quellen ließ und dabei auf die silbernen Tropfen des Metalls stieß. Noch im selben Jahr wurde an der Stelle mit der Anlegung des heute noch erhaltenen Antonius-Stollens begonnen. Das Bergwerk von Idrija entwickelte sich im Verlaufe von rund 500 Jahren zur zweitgrößten Quecksilbermine der Welt. |

|
|
Cinnabarit aus Almadén, Spanien. Betrachtet man den Cinnabarit mit der Lupe, so lassen sich kleine Tröpfchen von gediegenem Quecksilber erkennen. |

|
|
Wegen der großen Dichte des Quecksilbers schwimmt eine Stahlkugel auf dem flüssigen Metall. |

|
|
Transportgefäße für Quecksilber aus Gusseisen bzw. Stahl, aus mehreren Jahrhunderten stammend, zu sehen im Stadtmuseum von Idria (Slowenien). |

|
|
Quecksilber in Quecksilberwanne |
|
|
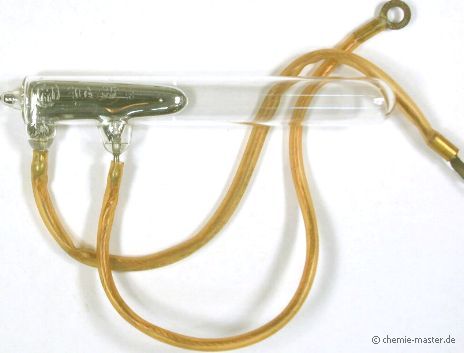
Quecksilber-Schaltkontakt für starke Ströme |
|
|
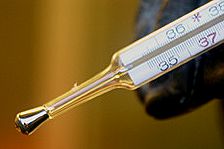
Altes Fieberthermometer mit Quecksilberfüllung. |
| 2 Hg ⇌ Hg22+ + 2 e– | +0,796 | Volt |
| Hg ⇌ Hg2+ + 2 e– | +0,854 | Volt |
| Hg22+ ⇌ 2 Hg2+ + 2 e– | +0,91 | Volt |