
chemie-master.de
Website für den Chemieunterricht
 |
chemie-master.de |
Website für den Chemieunterricht |
Actinoid
[Rn]5f77s2

|
|
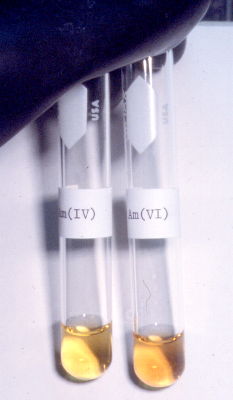
Dank an Dr. A. Kronenberg, www.kernchemie.de Americium in Brocken. |

|
Der größte Anteil des produzierten 241Am dient zur Gewinnung von 242Cm als Vorstufe von 238Pu. 241Am findet auch Verwendung in Neutronenquellen oder in Ionisationsrauchmeldern. |
Ionisationsrauchmelder sind mit zwei Ionisationskammern ausgestattet,
in denen die Luft von einem Americium-Strahler ionisiert wird. Das Americium
befindet sich als schwer lösliches Americiumoxid in einer dünnen
eloxierten Aluminiumfolie, die mit einer
 |
Nur Radionuklide, keine stabilen Isotope. |
| Am ⇌ Am3+ + 3 e– | –2,32 | Volt |
| Am3+/Am4+ | +2,44 | Volt |