
chemie-master.de
Website für den Chemieunterricht
 |
chemie-master.de |
Website für den Chemieunterricht |
Actinoid
[Rn]5f67s2





|
Sehr reaktionsfähiges, radioaktives Metall. Plutonium löst sich leicht in Salzsäure. Es ist unlöslich in Salpetersäure und konzentrierter Schwefelsäure. |
|
Die Abbildung links zeigt 0,89 g hochreines Plutonium (99,99%). Diese als Standard für analytische Zwecke gedachte Plutoniumprobe wurde im Los Alamos National Laboratory in einer sauerstofffreien Umgebung hergestellt und unter Vakuum in einer Glasampulle versiegelt. Foto: Los Alamos National Laboratory, USA |
| Plutonium - Element mit vielen Facetten |
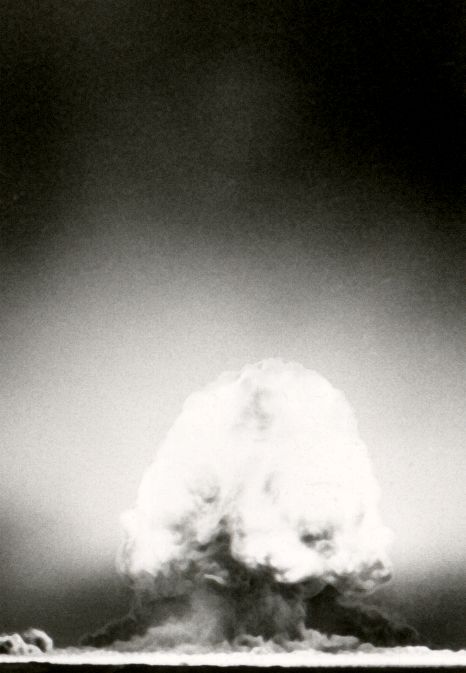
 |
Nur Radionuklide, keine stabilen Isotope. |
| Pu ⇌ Pu3+ + 3 e– | –2,03 | Volt |
| Pu3+/Pu4+ | +0,98 | Volt |
| Pu3+/PuO22+ | +1,02 | Volt |
| Pu4+/PuO22+ | +1,04 | Volt |
| Pu4+/PuO2+ | +1,17 | Volt |