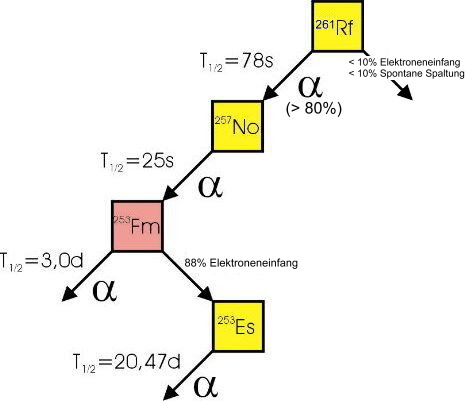
Kurzlebiges, radioaktives, nur künstlich darstellbares Element
(Transactinoid).
Nach der erstmaligen Herstellung des Rutherfordiums war die Frage von Interesse,
ob dieses neue Element in seinen chemischen Eigenschaften mehr den
Actinoiden oder mehr den Elementen Titan,
Zirconium und Hafnium aus der Nebengruppe IV b (4. Gruppe) ähnelt.
Erste experimentelle Beobachtungen (thermochromatografische Experimente
von Zvara u.a. im Jahre 1969) zeigten, dass Rf ebenso wie Zr und Hf
leichtflüchtige Chloride bildet, wohingegen die Chloride der Actinoiden
nicht flüchtig sind. 1970 konnten Silva u.a. darlegen, dass auch im
Bereich der wässrigen Chemie des Rutherfordiums Ähnlichkeiten
zu den Elementen der 4. Gruppe des PSE bestehen. 1980 konnten Hulet u.a.
anionische Chloridkomplexe herstellen, die denen des Hafniums entsprechen.
Die Bildung dieser Komplexe ist von den dreiwertigen Actinoiden nicht bekannt.
Es deutet - nach den bisherigen Experimenten zu urteilen - alles darauf hin,
dass Rutherfordium ein Element der
Nebengruppe IV b ist.

|

|
Die Abbildung zeigt das Verhalten der chemischen Homologen Hf, Zr
und Th in trägerfreiem Zustand (geringste Konzentrationen) am
Kationenaustauscher DOWEX 50WX8 in Abhängigkeit von der freien
Fluoridionenkonzentration:
Information: Dr. A. Kronenberg
|
|
Information: Dr. A. Kronenberg
Die Abbildung zeigt das Verhalten der chemischen Homologen Hf, Zr
und Th in trägerfreiem Zustand (geringste Konzentrationen) am
Kationenaustauscher DOWEX 50WX8 in Abhängigkeit von der freien
Fluoridionenkonzentration:
|
Die Sorption von Zr und Hf nimmt ab einer
Fluoridionenkonzentration von
3 ×10–6 M
ab, d.h. die kationischen Spezies von Zr und Hf verschwinden langsam komplett,
der Anteil von neutralen Spezies nimmt zu, gleichzeitig bilden sich aber
bereits anionische Spezies. Für Thorium verschwinden die kationischen
Spezies erst bei höheren Fluoridionenkonzentrationen von über
10–4 M. Die Abbildung zeigt auch die experimentell
bestimmten K
d-Werte für Rutherfordium mit Fehlerangaben.
Es zeigt sich, dass das Verhalten von Rutherfordium weder mit dem für
Hafnium und Zirconium - beide sind ebenso wie Rutherfordium Elemente der 4.
Gruppe -, noch mit dem von Thorium, einem Actinoid, übereinstimmt. Die
Verteilungskoeffizienten für Rf liegen vielmehr in der Mitte beider Kurven.
Weiterführende Informationen:
Weiterführende Informationen: