
chemie-master.de
Website für den Chemieunterricht
 |
chemie-master.de |
Website für den Chemieunterricht |
| So? | 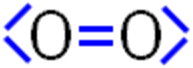 |
Oder so? | 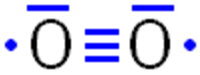 |
|---|
Sauerstoff ist eines der häufigsten Elemente auf der Erde. In der Atmosphäre ist er zu 21 Volumenprozent (23,15 Masseprozent) vorhanden. Der Sauerstoff, den wir atmen, der so genannte Luftsauerstoff, besteht aus Sauerstoff-Molekülen in denen zwei Sauerstoff-Atome miteinander verbunden sind. In der Natur wird dieser Sauerstoff von den Pflanzen durch die Fotosynthese hergestellt und freigesetzt.
Die Fotosynthese dient den Pflanzen zur Erzeugung von energiereichen organischen Verbindungen, wie z.B. dem Kohlenhydrat Glucose. Diese werden aus energiearmen anorganischen Stoffen - hauptsächlich Kohlenstoffdioxid CO2 und Wasser H2O - mit Hilfe von Lichtenergie synthetisiert.
Vereinfacht kann man die Reaktion bei der Fotosynthese in zwei Teilreaktionen unterteilen. Hier die Reaktionen zur Gewinnung von Glucose:
Die Pflanzen benötigen die organischen Verbindungen zum Aufbau ihrer Substanz und zur Gewinnung von Energie. Der entstandene Sauerstoff in der Lichtreaktion wird als »Abfallprodukt« in die Luft freigesetzt.
Der Luftsauerstoff besteht aus zweiatomigen Molekülen. Jedes Sauerstoff-Atom hat, entsprechend seiner Stellung in der VI. Hauptgruppe, zwei innere und sechs äußere Elektronen. Verbinden sich nun zwei Sauerstoff-Atome, so könnte man eine Doppelbindung und jeweils zwei nicht-bindende Elektronenpaare vermuten.
Diese Art von Sauerstoff-Molekülen gibt es tatsächlich - aber nur in sehr geringem Maße, da sie extrem reaktiv und daher kurzlebig sind. Man nennt dieses Sauerstoff-Molekül »Singulett-Sauerstoff« oder auch »diamagnetischer Sauerstoff«.
Der Luftsauerstoff kann bei Anwesenheit von bestimmten Farbstoffmolekülen und mit Hilfe des Sonnenlichts (Lichtenergie) in den angeregten Singulett-Zustand überführt werden. Dabei wird nur das »blaue Licht« nicht absorbiert und der Himmel erscheint blau.
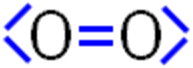
Im Labor kann Singulett-Sauerstoff aus Wasserstoffperoxid und Natriumhypochlorit hergestellt werden:
In der organischen Chemie wird dieser Sauerstoff (1O2) als Oxidationsmittel eingesetzt, da er organische Verbindungen selektiv angreift.
Der gasförmige Luftsauerstoff bevorzugt aber eine energieärmere Form. Bei der Reaktion von zwei Sauerstoff-Atomen bildet sich eine Dreifachbindung, jeweils ein nicht-bindendes Elektronenpaar und jeweils ein einzelnes Elektron:
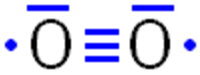
Diese Form stellt ein Radikal dar. Als Molekül mit zwei einzelnen Elektronen wird das Sauerstoff-Molekül als Biradikal bezeichnet. Weitere gängige Bezeichnungen für diese Art von Sauerstoff-Molekülen sind »paramagnetischer Sauerstoff« (da er einzelne Elektronen besitzt), »Triplett-Sauerstoff« (da seine Spin-Multiplizität 3 ist) oder Kombinationen der einzelnen Bezeichnungen.
Die Biradikalform der Sauerstoff-Moleküle ist dafür verantwortlich, dass der Luftsauerstoff nicht mit organischen Verbindungen reagiert. Möchte man Triplett-Sauerstoff zur Reaktion bringen, z.B. mit Holz am Lagerfeuer, so benötigt man immer eine Aktivierungsenergie oder Katalysatoren, die die Aktivierungsenergie herabsetzen. Eine Reaktion des Holzes mit dem Luftsauerstoff wird bei Raumtemperatur aber niemals spontan ablaufen.
Im Gegensatz zum Triplett-Sauerstoff reagiert der Singulett-Sauerstoff mit vielen organischen Verbindungen auch ohne eine »Zündreaktion«.
Der Grund für das unterschiedliche Reaktionsverhalten beider Sauerstoff-Formen ist der, dass die Reaktion von paramagnetischem Sauerstoff (Triplett-Sauerstoff) mit diamagnetischen Stoffen - sehr viele organische Verbindungen sind diamagnetisch - physikalisch verboten ist.
Nicht verboten hingegen ist, dass der paramagnetische Sauerstoff (also unser Luftsauerstoff) mit paramagnetischen Stoffen reagiert. Ein Beispiel hierfür ist das Rosten von Eisen. Dabei reagiert der Luftsauerstoff »spontan«, also ohne dass eine Startenergie zugeführt werden muss, mit dem Eisen zu Eisenoxid, eben dem Rost.
Es ist ebenfalls nicht verboten, dass diamagnetischer Sauerstoff (Singulett-Sauerstoff) mit diamagnetischen Stoffen reagiert. Daher wird er in der organischen Chemie als selektives Oxidationsmittel verwendet. Er reagiert »spontan« mit den sehr häufig vorkommenden diamagnetischen organischen Verbindungen.