
chemie-master.de
Website für den Chemieunterricht
 |
chemie-master.de |
Website für den Chemieunterricht |
Metall
Erdalkalimetall
II. Hauptgruppe
[Rn]7s2


|
|
Pierre und Marie Curie an ihrem Arbeitsplatz in der angemieteten Fabrikhalle in Paris, in der sie 1898 das Polonium und das Radium entdeckten. |

|
|
Foto: Deutsches Museum München 2,5 Gramm Radiumbromid in einem Wägeröhrchen. Auf Grund der starken Radioaktivität leuchten Radiumverbindungen im Dunkeln. Die fotografische Aufnahme erfolgte mit Hilfe des von dem Präparat selbst ausgesandten Lichts. |

|
|
226Ra-Strahlenquelle: Im Deckel des Bleibehälters
(rechts) sind |

|
|
Die Himmelsrichtungen dieses Kompasses der deutschen Wehrmacht aus
der Zeit des |
|
|
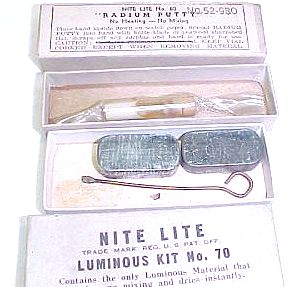
Der abgebildete »Leuchtkit« enthält eine mit Radium versetzte Paste, mit der zu markierende Flächen bestrichen werden konnten. |
| CHEMIE-MASTER® - Periodensystem: Radium: Geschichtliches |
 |
Nur Radionuklide, keine stabilen Isotope. |
| Ra ⇌ Ra2+ + 2 e– | –2,92 | Volt |